인공지능(AI)이 실제 의료 진단에 활용될 수 있는 길이 점차 확대되고 있다. 앞서 국내 의료 AI 스타트업 '뷰노'의 CT 기반 폐결절 검출 솔루션이 식약처 2등급 인허가를 받은 데 이어, 코어라인소프트의 AI 기반 폐암 검진 솔루션이 미국식품의약국(FDA) 승인을 받았다는 소식이 전해졌다.
코어라인소프트는 폐암 검진 솔루션 '에이뷰 엘씨에스(AVIEW LCS)'가 FDA로부터 510(k)승인을 받았다고 밝혔다. 에이뷰 엘씨에스는 저선량 흉뷰CT(LDCT) 판독지원 솔루션으로, 현재 국가 폐암 검진의 공식 소프트웨어로 사용되고 있다. 폐암으로 진행될 수 있는 결절의 조기 판독을 지원한다.
FDA 510(k) 인증은 유통하고자 하는 의료기기가 사용목적, 기술적 특성, 성능 검사에서 기존의 장비와 실질적으로 동등하다는 것을 증명하는 '시판 전 신고(Premarket Notification)'다. 실제 시중에 판매되는 장비와 같은 안전성을 인정받는 만큼, 향후 국내외 의료 AI 시장 확대에 긍정적인 영향을 미칠 것으로 기대된다.
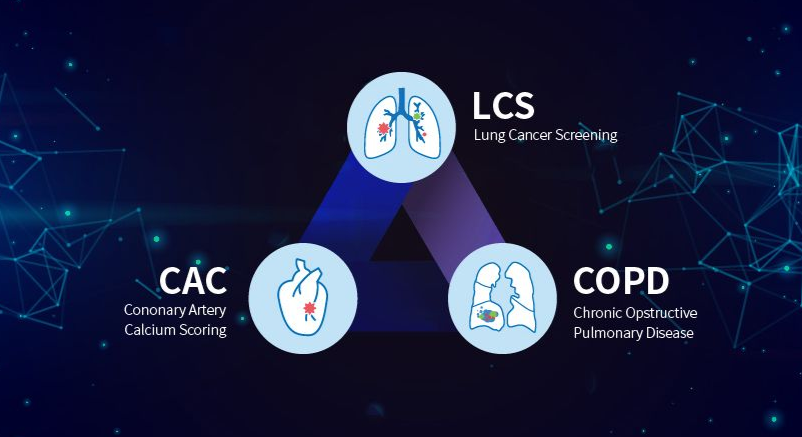
코어라인소프트 관계자에 따르면 에이뷰 엘씨에스는 앞선 2017년 식약처 AI 의료 부문 2등급 인허가를 받았다. 2등급은 획득된 의료용 영상을 모의 치료와 모의 시술에 활용할 수 있는 내용의 인허가다. 뷰노의 경우 얼마 전 안과 분야에서 실제 현장에서 의료 진단 보조도구로 사용할 수 있는 3등급 인허가를 획득해 국내 저변을 넓혔으며, 코어라인소프트는 이번 FDA 승인을 통해 해외 시장 진출의 기반을 마련한 것이다.
현재 국내에서는 국립암센터와 서울대학교병원, 고려대학교병원, 울산대학교병원, 광양사랑병원, 순천드림내과 등 지역 거점 병원을 포함해 54개 병원이 에이뷰 엘씨에스를 사용하고 있고, 해외에서는 미국, 독일, 중국 등 7개 병원이 도입 중이다.
최근 미국과 유럽에서는 CT를 이용한 폐암 조기검진의 중요성이 강조되는 추세다. 유럽 최대 폐암 검진 임상시험인 ‘네덜란드-벨기에 폐암 스크리닝(NELSON)’은 10년에 걸친 연구 결과, 매년 LDCT로 검진받은 환자가 그렇지 않은 환자보다 폐암으로 사망할 확률이 최대 39% 낮다는 결과를 올해 1월 NEJM(New England Journal of Medicine)에 발표했다.
현재 의료 진단보조용 AI는 대개 인간 전문의 수준의 판독 정확성을 지닌 것으로 알려져 있다. 아직 AI가 직접 병증을 진단할 수 있는 지위까지 인정받진 못했지만 일선에서는 의료진을 도와 진단 속도를 개선하고 오진을 줄이는 데 기여하고 있다. 특히 코로나19 대유행으로 폐 진단 AI에 대한 관심도 지속해서 높아지고 있다.
박혜이 코어라인소프트 인허가 담당 부장은 "이번 FDA 승인은 딥러닝 기반으로 폐와 로브를 분할하는 과정, 폐 CT 선별 보고 및 데이터 시스템(Lung-RADS) 워크플로우 지원 등의 내용을 중심으로 승인됐다"며 "향후 유럽 CE 인증과 싱가포르 및 동남아, 일본 등에서 지속적인 인허가 확대를 목표로 하고 있다"고 전했다.
한편, 기존 폐암검진 프로세스에도 AI 기반 예측 모델이 적용될 예정이다. 지난해 대한폐암학회는 올해까지 폐암검진대상을 61만명으로 늘리고, 2023년부터는 이들 대상자와 함께 폐암 발생 예측 모델을 적용한다는 계획을 밝힌 바 있다.