셀트리온이 개발한 코로나19 치료제가 페루에 진출한다.
셀트리온의 페루 진출은 중·후진국의 ‘허가 프리패스 티켓’이라 불리는 유럽 당국의 사용 승인을 획득한 후 이뤄졌다. 바이오업계에선 셀트리온의 해외 시장 진출이 가속화될 것이란 전망이 나온다.
셀트리온은 22일 자사가 개발한 코로나19 항체치료제 ‘렉키로나(성분명 레그단비맙)’가 페루 의약품관리국(DIGEMID)의 조건부 사용 허가를 획득했다고 밝혔다. 이로써 렉키로나 사용 국가는 우리나라·유럽·브라질·인도네시아에 이어 페루까지 확장됐다.
페루 의약품관리국은 국내 식품의약품안전처(식약처)와 유사한 기능을 수행하는 기관이다. 페루에서 유통되는 모든 의약품은 의약품관리국의 품목 허가(Registro Sanitario)를 받아야 한다.
셀트리온은 지난 12일 렉키로나에 대한 유럽연합집행위원회(EC)의 정식 품목허가를 획득했다. 이 승인 발표는 유럽의약품청(EMA) 산하 약물사용자문위원회(CHMP)로부터 ‘승인 권고’ 의견을 획득한 지 하루 만에 이뤄졌다. EC는 CHMP 의견 접수 후 통상 1~2개월 이내에 정식 품목허가 여부를 내놓는데, 렉키로나는 매우 이례적으로 신속하게 승인 처리했다.
EC는 판매 허가를 까다롭게 내리는 규제 기관으로 꼽힌다. 안전성·효능 등에 대한 데이터를 수차례 검증한 후 승인을 내준다. 이 때문에 EMA 승인은 중·후진국의 ‘허가 프리패스 티켓’으로 여겨진다.
셀트리온은 아시아·중남미·중동 등 약 30개 국가와 렉키로나 허가신청 및 판매 협상을 진행 중이다. 유럽 당국의 승인을 바탕으로 각국에 대한 허가가 조속히 이뤄질 것이란 전망이 나온다. 바이오업계 관계자는 “페루 의약품관리국이 렉키로나에 대한 평가 과정에서 유럽 승인 결과를 고려했을 가능성이 크다”며 “셀트리온은 해외 진출 영역을 넓힐 수 있는 여건을 마련한 상태”라고 설명했다.
셀트리온은 렉키로나에 대한 글로벌 임상 3상을 지난 6월 마치며 안정성·유효성을 확보했다. 렉키로나를 투여한 고위험군 환자군에선 중증환자 발생률이 위약군(임상의약 효과를 검증할 때 효과가 없는 약을 투여한 집단) 대비 72%, 전체 환자에선 70% 감소했다. 임상적 증상 개선 시간 역시 단축된 것으로 나타났다. 고위험군 환자에게선 위약군 대비 4.7일 이상, 전체 환자에게선 4.9일이 단축돼 통계적 유의성을 확보했다.식품의약품안전처(식약처)는 렉키로나의 임상 3상 결과 등을 검토한 후 정식 품목허가를 내기도 했다. 중앙방역대책본부에 따르면 렉키로나는 18일 집계 기준 130개 병원에서 2만3781명 환자에게 투여됐다.
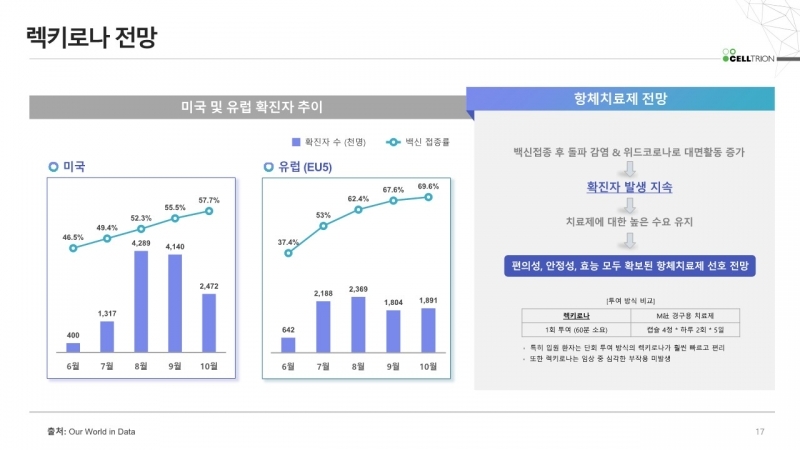
렉키로나는 페루에서도 활발하게 사용될 전망이다. 코로나19 실시간 통계 사이트 월드오미터에 따르면 22일 기준 페루의 코로나19 누적 확진자는 220만명을 넘어섰다. 누적 사망자는 20만명을 돌파했다. 일일 확진자는 1700명 수준을 기록하고 있다. 페루는 올해 초 코로나19 일일 확진자 1만명 수준을 기록하며 대유행을 겪은 바 있다.
셀트리온 관계자는 “렉키로나의 대규모 글로벌 임상 데이터를 통해 입증된 안전성과 효능을 바탕으로 페루 보건당국으로부터 조건부 사용허가를 획득하게 됐다”며 “전 세계 위드 코로나 도입 후 급증하는 코로나19 확산 방지에 기여할 수 있도록 최선을 다하겠다”고 말했다.